水溶液 の 濃度 計算
基本的な計算問題の解き方 次のような問題が基本問題として出題されます 水114gに食塩を6gとかしたとき、何%の食塩水が何gできるか 食塩水の質量=114+6=1 濃度=6÷1×100=50(%) 割合の考え方で溶質、水溶液の量を求めることができる.

水溶液 の 濃度 計算. 水の質量は8172 x = 約8165g で、合計すると 9752gとなる。 この時、アルコール度数%の水溶液は100ccであるので、9752g を100で割ると密度は、と計算できる。 国際アルコール表、つまりアルコール度数と密度の表から、水分 (体積%)、アルコール. 水溶液の水素イオン濃度計算 何度やっても答えが出ません教えてください(・・;) 水溶液の水素イオン濃度を求めてください。 ただし、強酸強塩基の電離度は1(完全電離)とする (1) 005mol/Lの塩酸 (2) 005mol/Lの硫酸 やり方も教えてくださると嬉しいです!. 濃度計算 質量パーセント濃度を求めよ。(割り切れない場合は小数第1位を四捨五入して整数で答えよ) 0gの水溶液の中に、溶質が30gが溶けている場合。 水460gに溶質40gを溶かした水溶液。 150gの水溶液のうち、100gが溶媒の場合。 次の問いに答えよ。.
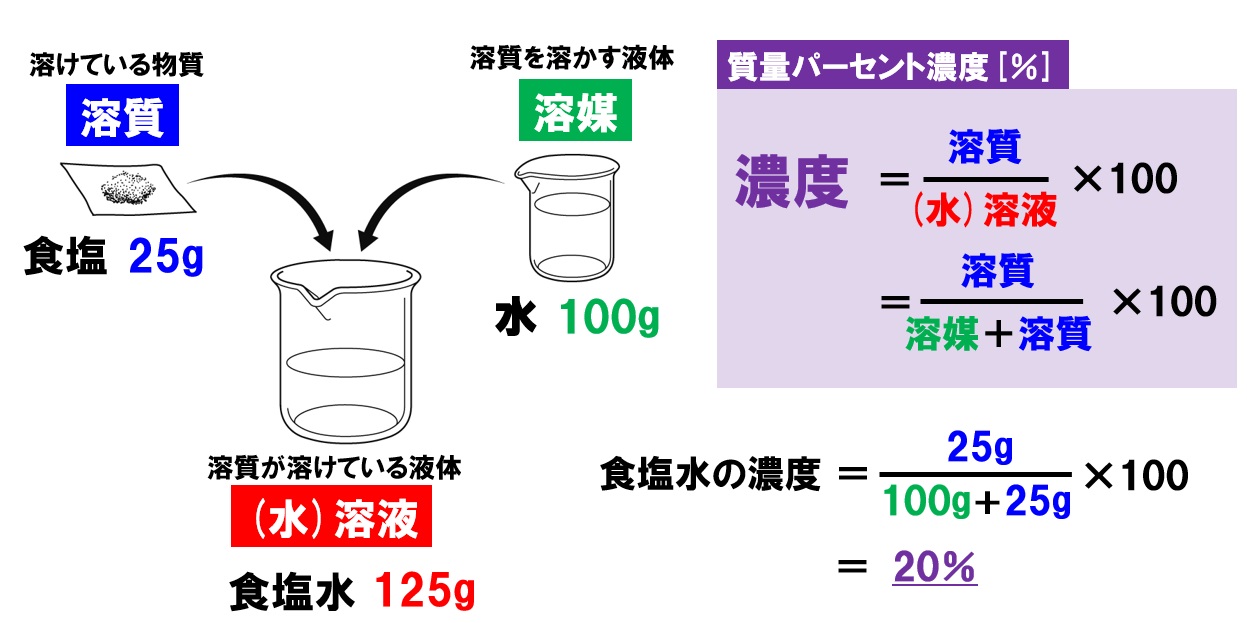
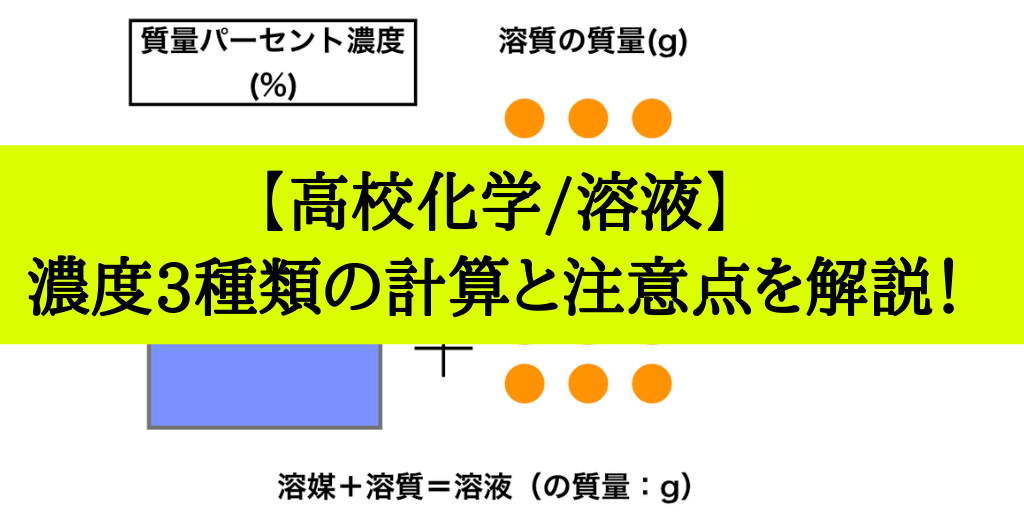
(質量パーセント濃度 % )= (溶質の質量)÷(溶液の質量)×100 だ。 もうちょっと簡単に言ってあげると、 「溶かす物質の重さ」を「溶けてできた液体の重さ」で割って「100」をかければいいんだ。 つまり、質量パーセント濃度とは、 「溶かした物質の重さ」が「溶けてできた液体全体の重さ」のうち何パーセントをしめるのか? を表した割合のことなんだ。 たとえ. 中学1年理科。水溶液と濃度について学習します。 レベル★★★☆ 重要度★★★☆ ポイント:濃度の計算方法授業用まとめプリントは下記リンクからダウンロード!授業用まとめプリント「水溶液と濃度」水溶液とは水溶液とは、物質が水に溶けたもので. 最初に触れましたが、質量パーセント濃度は以下の式で求められます。 質量パーセント濃度 (%)= 溶質の質量(g)÷ 溶液(溶質溶媒)の質量(g)×100 これは、溶液の中に溶けている溶質が全体の何パーセントかということです。 食塩水で例えると食塩水(g)中に食塩(g)が何パーセント含まれているかを表しています。 ID ↑パーツ内本文:170文字 13質量パーセント濃度の練習問題 質量.
液体のエタノールを水に溶かしてエタノール水溶液ができます。 気体の溶質だと、炭酸水などがありますね。気体の二酸化炭素を水に溶かして炭酸水溶液ができます。 モル濃度とは モル濃度とは、溶質の物質量molを溶液の体積Lで割ったものです。. 26 石井・寺窪:水溶液濃度計算におけるつまずきの要因分析と学習指導法の検討 水溶液100 g をつくるために,必要な塩化ナトリウム と水の質量は,それぞれ何g ですか.」の設問におい て,正答率が460%と,「知識」(技能)に関する問題. 原液 ÷ 切削液 x 100 = 濃度 を変形すると、 原液 = 濃度 x 切削液 ÷ 100 となります。 これを倍率の計算式に入れると 切削液 ÷ (濃度 x 切削液 ÷ 100)= 倍率 となり、 倍率(倍) = 100 ÷ 濃度 が成り立ちます。 上記の 黄色マーカー部分2つ がわかっていると 濃度と倍率を換算できます。 濃度から倍率に換算 濃度5%の切削液 ⇒ 100 ÷ 5 = 倍 倍率から濃度に換算 倍の切削液 ⇒ 100.
水素イオン濃度とpH まずはじめに 水溶液の酸性や塩基性の強さを表す尺度として pH(水素イオン指数) を使いました。 pHは数値が0~14まで存在し、pHの値が7のとき中性で、7より値が小さいほど酸性が強く、7より値が大きいと塩基性が強くなります。. 使用目的 趣味のカクテル作りでおおよそのアルコール度数を計算するため。 アンケートにご協力頂き有り難うございました。 送信を完了しました。 濃度算(混ぜる) のアンケート記入欄 年齢 歳未満 歳代 30歳代 40歳代 50歳代 60歳以上 職業. このように、10×1013 というきわめて小さい濃度にはなりますが、酸の中にも微量のOH - が存在しているということはちょっと不思議に思えます。 (例2) 001mol/Lの水酸化ナトリウムNaOH溶液のpHはいくらになるかを考えてみましょう。 水酸化ナトリウムNaOHは、水に溶けて次のように電離し.
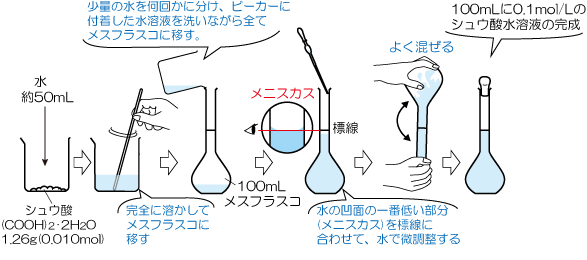
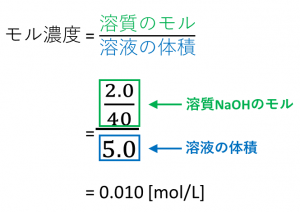
シュウ酸水溶液の濃度は、 100mLのうち滴定に使うのは10mLです。 ここまでの操作でやっと中和滴定の準備ができました。 ここからはただの中和反応の計算です。 シュウ酸水溶液の濃度と使う量がわかったので、 水素イオンの数を数えてみましょう。. (1) まず質量パーセント濃度 (%)から溶質 (g)と溶液 (g) を求めましょう。 質量パーセント濃度 (%)= 溶質の質量(g)÷ 溶液(溶質溶媒)の質量(g)×100なので、15 (%)の水酸化ナトリウム溶液は溶液100g中に15gの水酸化ナトリウム(溶質)が溶けていることになります。 今、簡単に溶液100gと仮定しましたが、これは、溶液1000g中に15gの水酸化ナトリウムが溶けていると仮定しても同じこ. molの水酸化ナトリウム(NaOH)を水に溶かして全体で40Lにしたときのモル濃度mol/Lを求めよ。 公式に当てはめると次のようになる。 モル濃度 溶質 溶液 モ ル 濃 度 ( m o l / L) = 溶 質 ( m o l) 溶 液 ( L) = ( m o l) 40 ( L) ≒ 050 ( m o l / L) 毎回このように出題してくれれば簡単だけど、実際はもう少しひねった問題が出されることが多い。 次は少し応用の「gとLが与えられ.
溶液の質量 ⇨つまり、食塩水の量なので、水70g塩30g=100g とわかります。 つまり、公式に当てはめると、 これを計算すると答えは、 30% になります! 溶解度の計算方法 溶解度曲線を使った問題①溶解度の読み取り 教科書や問題集に、このようなグラフが出てきますよね。 このグラフは、 溶解度曲線 といいます。 溶解度曲線を使ったポピュラーな問題を紹介しながら、このグ. この水溶液の濃度が何%かを求める問題です。 まずは、全体の重さを求めましょう。 362=400より、 全体は400g です。 そのうち、 食塩は32g 含まれていることになります。 それでは、 濃度をx% とおいてみましょう。 濃度の式を覚えていますか?. 溶液の質量 = 溶質の質量 溶媒の質量 となります。 溶かしたものと溶けたものの合計した重さのことです。 これを式を使って表してみます。 重 要 濃度(%)=溶質の質量(g)÷ 溶液の質量(g)×100 濃 度 ( % ) 溶 質 の 質 量 ( ) 溶 液 の 質 量 ( ) 濃 度 ( % ) = 溶 質 の 質 量 ( g ) 溶 液 の 質 量 ( g ) × 100 この式は濃度の求め方の基本ですのでしっかり覚えましょう。 飽.
質量パーセント濃度を求めるためには、それを求めるための式に含まれている”溶質”と”溶媒”の量が分かっていれば解くことが出来ます! その量は溶媒180gと溶質gであるとわかっているので、これを上で示した質量パーセント濃度の式に当てはめてみると、 ÷ (180)×100=÷0×100=10 となり、この水溶液の濃度は10%と分かります。 単純な式なので、意外と簡単に解けたのではないで. 解説 水をxgとして方程式をたてる 塩化ナトリウム (溶質) 水 (溶媒) = 溶液 なので 溶液は (30x)g 溶質= 質量パーセント濃度 100 ×溶液より 30 = 4 100 × (30x) これを解いて x = 7 (4)答45g 解説 塩化ナトリウムをxgとして方程式をたてる 塩化ナトリウム (溶質) 水 (溶媒) = 溶液 なので 溶質xg, 溶液 (x330)g 溶質= 質量パーセント濃度 100 ×溶液より x = 12 100 × (x330) こ. この値を上の式にあてはめて計算するとモル濃度がわかります。 1114 g/mL x 1,000mL x 100w/w%/100 ÷ 7813 = 1426mol/L このように濃度を求めるには「比重(または密度)」「純度(または含量)」「分子量」の3点がわからなければなりません。.
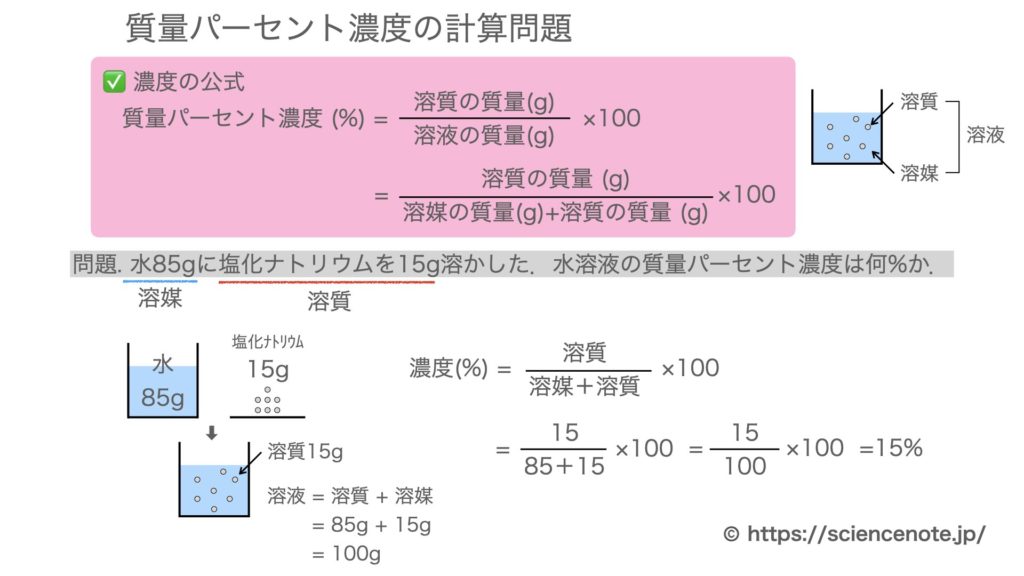
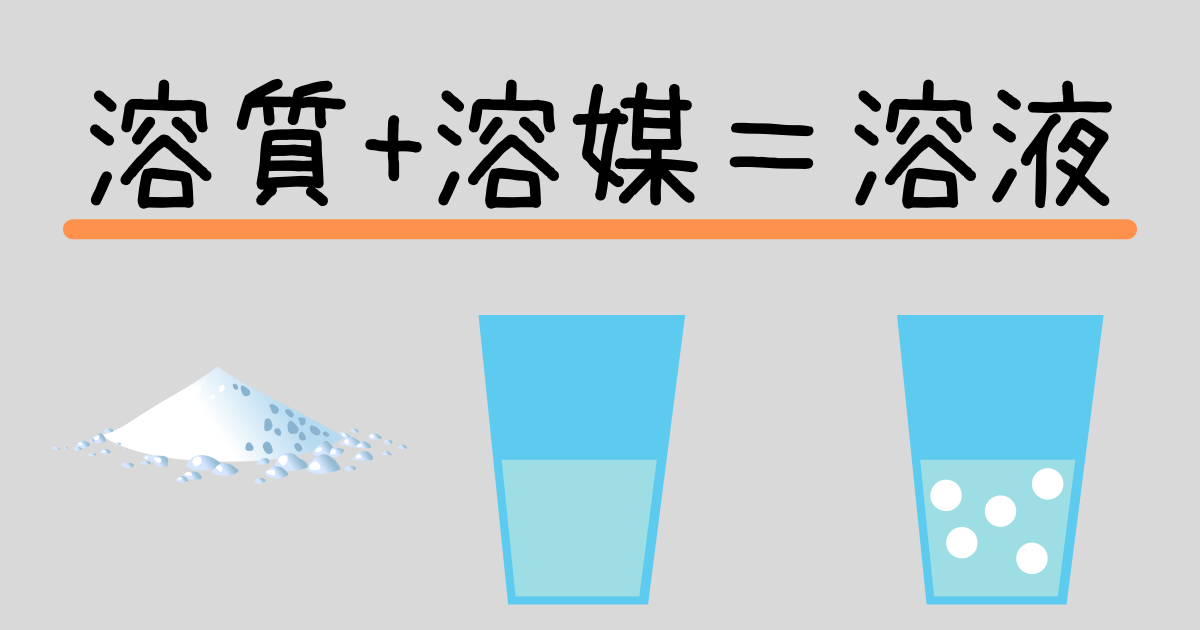
水溶液の濃度(質量パーセント濃度):公式と求め方 水溶液の濃さは溶質の質量を水溶液の質量で割って100をかけて求めます。 溶質の質量÷水溶液の質量×100 この値を質量パーセント濃度ともいいます。 単に濃さという場合は、この質量パーセント濃度を指します。 パーセントという名前がついているように単位はパーセントです。 例1 水溶液300gに食塩が60g入っている。 質量パーセント濃度. 使用目的 苛性濃度の計算を算出する為に使いました。 ご意見・ご感想 以下の条件のものを求める式があれば他にも応用できるのですが・・・・苛性濃度25%の物を真水400Lに入れて苛性濃度を15%にするには苛性濃度25%を何リットル入れれば良いのか?. 化学溶液の 濃度を計算することは、化学の すべての学生が研究の早い段階で開発しなければならない基本的なスキルです。 集中力とは何ですか?濃度とは、溶媒に溶解している溶質の量を指します。 通常、溶質は溶媒に添加される固体と考えられます(たとえば、水に食卓塩を添加す.
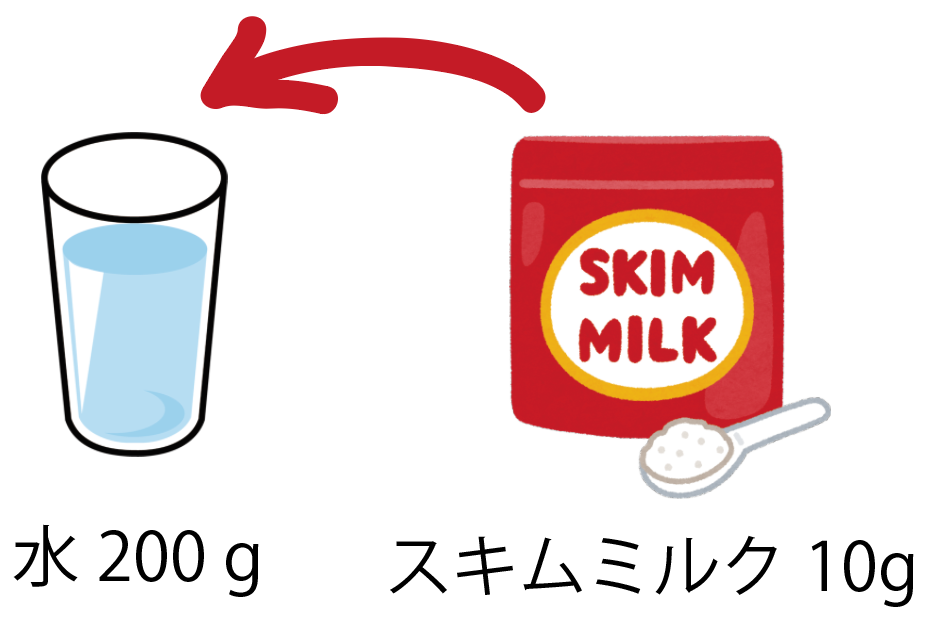
の公式で計算してみると、 (質量パーセント濃度 % ) = (砂糖の質量)÷(砂糖水の質量)×100 = 8 ÷ 0 ×100 = 4 % になるね! 練習問題2 「溶液の質量が書いてない問題」 スキムミルク10gと、水0gを混ぜて、牛乳みたいな飲み物を作ってみました。. 010mol/ℓの水溶液ですから、100mℓの水溶液中に溶質のNaClは0010mol溶けていればいいことになります。 そこで、0010molのNaCl(式量585) 正確に量りとって、水に溶かして100mℓの水溶液にします。 NaClの式量は585ですから、0010×585=0585gですね。. 水溶液の濃度にまつわる練習問題 解答 %の食塩水、 %の砂糖水といった、水溶液の「濃度」についての計算問題プリントです。 苦手な人が多いけど、しっかり身につけよう! 数学でも役に立つ場面があるよ (^ ^) 溶解度曲線の見方 練習問題 No 1 溶解.
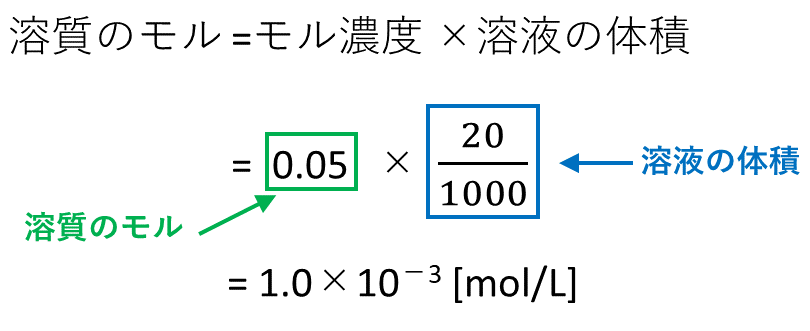
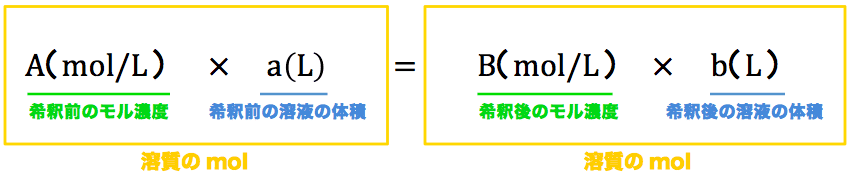
水溶液の液性は、水溶液中の水素イオンのモル濃度h で決まる。25℃において、 モル計算や濃度計算、反応速度計算など入試頻出の計算問題を一通りマスターできるシリーズとなって. 食酢の希釈前のモル濃度を y 〔mol/L〕とします。 この食酢を500mLからmLに希釈しています。 次に,NaOHからのOH − の物質量を計算します。 水酸化ナトリウム水溶液の濃度は(1)より010 mol/Lで,175mLの滴定で中和点に達しています。 アドバイス 公式は丸暗記するのではなく,どのようにして公式が導かれたのかその意味を理解しておくことが重要です。 高1チャレンジの. 溶質の物質量 mol / 溶液の体積 L で計算できるので、 求めるモル濃度は 05 mol / 2 L = 025 mol/L・・・(答) となります。 モル濃度は、溶質の物質量 mol / 溶液の体積 Lで計算できるので単位は mol/Lとなります。 3:モル濃度から質量パーセントへの変換方法 高校化学の問題では、密度が与えられて、 「モル濃度からパーセント質量へ変換せよ」という問題がよく出題.
モル濃度は 溶液1L中の溶質のモル数を表す濃度の単位です。 w/v%とmol/LとNの関係 塩酸(HCl水溶液)の場合 HCl は1個のH + を放出できます。 価数(反応単位)は1です。 HClの1モルは1当量です。 HClの1mol/Lは1Nとなります。 HClの分子量を 36とすると 1グラム当量. ツイート 物質が見ずに溶ける様子や、水溶液から溶質を取り出す実験方法、水溶液の質量パーセントの求め方(数式)などを確認、練習できる問題プリントです。 水溶液の性質 (1) 答え 水溶液の性質 (2) 答え 水溶液の性質 (3) 答え 水溶液の. 濃度 (%)中心に薬液量計算を行う方法 ※わからない部分はXとする ※原液の濃度 (%)×薬液量 (ml)=希釈液の濃度 (%)×希釈液量 (ml) 上記の計算方法に当てはめると、10%塩化ナトリウム水溶液の必要な量がわかっていないので、 10×X=02×500 10X=100 X=10 となり、答えが10mlと出ます。 溶質の量を求め、全体量から必要量を出す方法 まず02%塩化ナトリウム水溶液500mlの溶質.

Akiya Su 在 Twitter 上 理科 質量パーセント濃度 溶質 溶媒 溶液と公式を覚えること 計算は難しくないが 割り算の筆算で小数点の位置がわからない人は先生に聞こう 中学理科 質量パーセント濃度 T Co Tri1p3fn72 Twitter

濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン

1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 ページ 2 4 Study Z ドラゴン桜と学ぶwebマガジン
水溶液 の 濃度 計算 のギャラリー

3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく

溶液濃度換算 Youtube

基礎化学3 溶液

高校化学 質量モル濃度 映像授業のtry It トライイット
水溶液と質量パーセント濃度の計算問題 Hiromaru Note
100画像 理科 質量 の 求め 方 新しい壁紙アニメ
濃度算 混ぜる 高精度計算サイト

濃度の応用

この問題の一つ目の モル濃度を求める計算の部分で 1 1 11と 1 100 Clearnote

看護学部の化学講義 9 濃度のあらわし方 Life Chemistry

中1 理科 中1 32 質量パーセント濃度 Youtube

質量パーセント濃度の計算問題集 基本編 Menon Network
溶液の質量パーセント濃度の求め方と比重を利用した計算問題

中和滴定による濃度の決定について計算式の意味がわかりません 理科 苦手解決q A 進研ゼミ高校講座

Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ
中1理解の 質量パーセント濃度 公式ですが く も わみ Yahoo 知恵袋

食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun
受験化学 9 溶解度の計算1 みかみの参考書ブログ
水溶液と質量パーセント濃度の計算問題 Hiromaru Note

高校化学基礎 硫酸とモル濃度 映像授業のtry It トライイット

中学理科 水溶液の濃度と飽和 溶解度 偏差値40プログラマー

基礎化学3 溶液

4 6 溶液の濃度 おのれー Note

質量パーセント濃度の計算問題集 基本編 Menon Network
モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine
中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu

医療工学科の化学講義 16 溶液濃度計算問題演習 Life Chemistry

中1理科 濃度の計算 映像授業のtry It トライイット

中学受験 理科 水溶液の濃度計算の基礎 中学受験プロ家庭教師 チャーリー先生のブログ
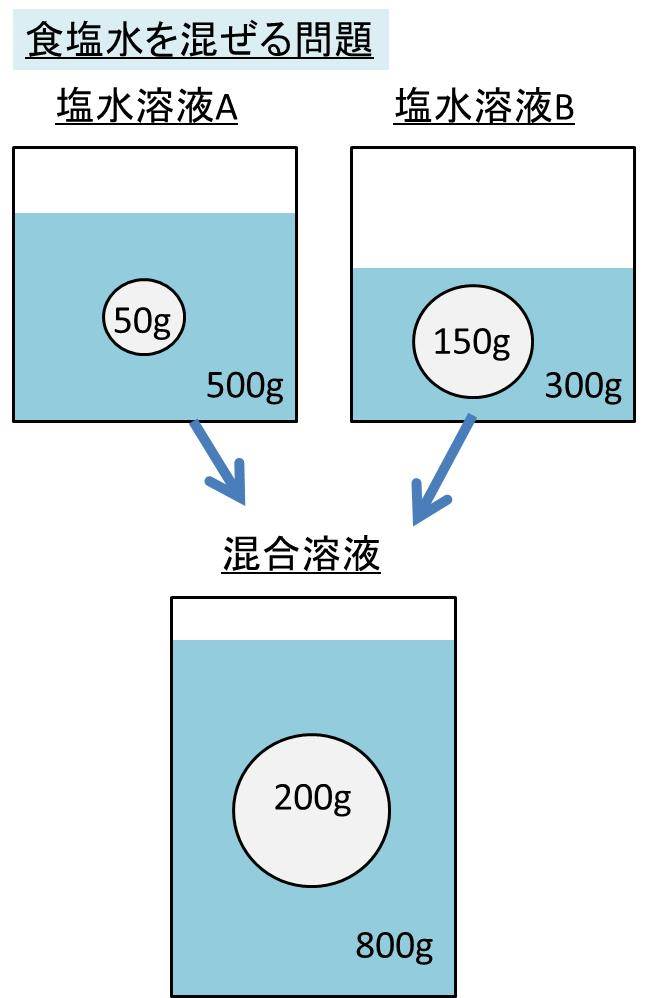
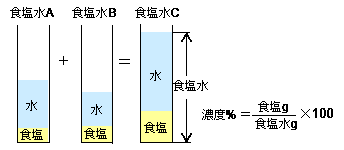
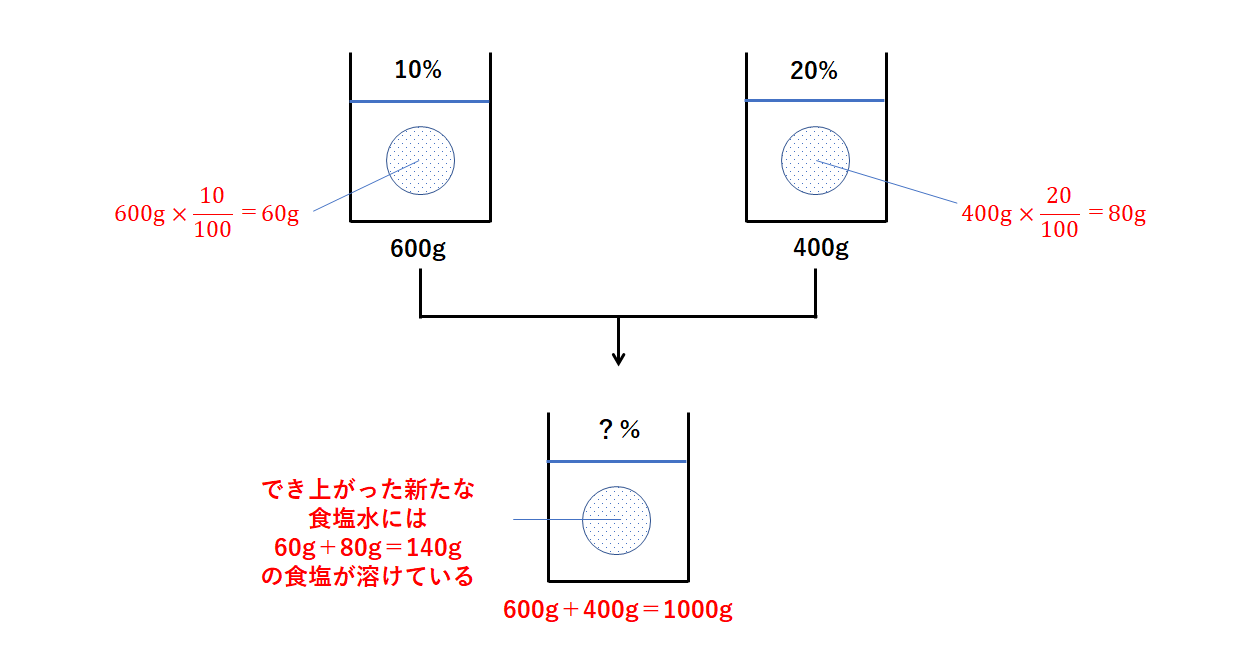
Spi 異なる濃度の食塩水を混ぜる問題の計算方法 濃度算

モノマナビ研究所

溶液の質量パーセント濃度の求め方と比重を利用した計算問題

質量パーセント濃度に関する問題です 0 4がどこから出てきたのかわかりません Clearnote

4 6 溶液の濃度 おのれー Note

濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン
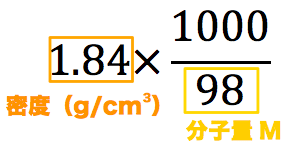
モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ
中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu

Science 物質 溶解度と濃度 働きアリ
中1化学 水溶液 濃度 中学理科 ポイントまとめと整理

実習21 水溶液の濃度 1年理科 化学 Takaの授業記録12

モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ

水溶液の性質と質量パーセント濃度の計算 溶液 溶質 溶媒 の意味 中学理科要点 Yattoke 小 中学生の学習サイト
5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する

基礎化学3 溶液

中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu

質量パーセント濃度の計算問題集 応用編 Menon Network

医療工学科の化学講義 16 溶液濃度計算問題演習 Life Chemistry
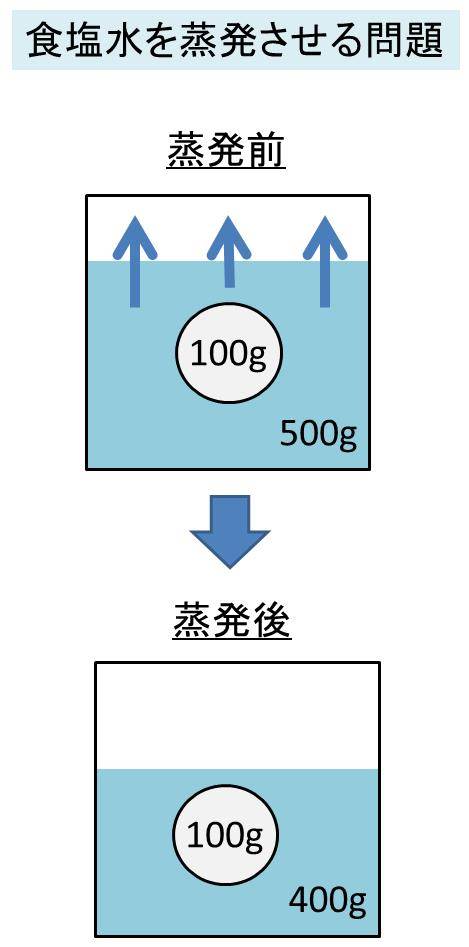
Spi 食塩水を蒸発させたときの濃度の計算方法 濃度算

濃度計算を素早く 化学がちょっとだけ好きな社労士
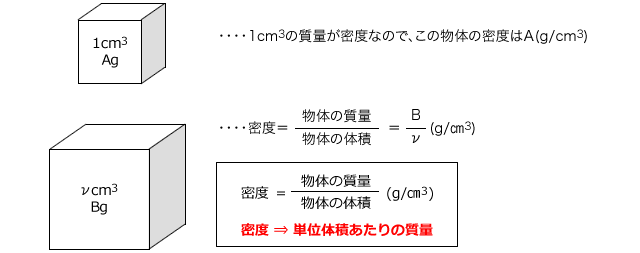
化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム
1

見にくくてすいません 化学の質量パーセント濃度計算で Clearnote
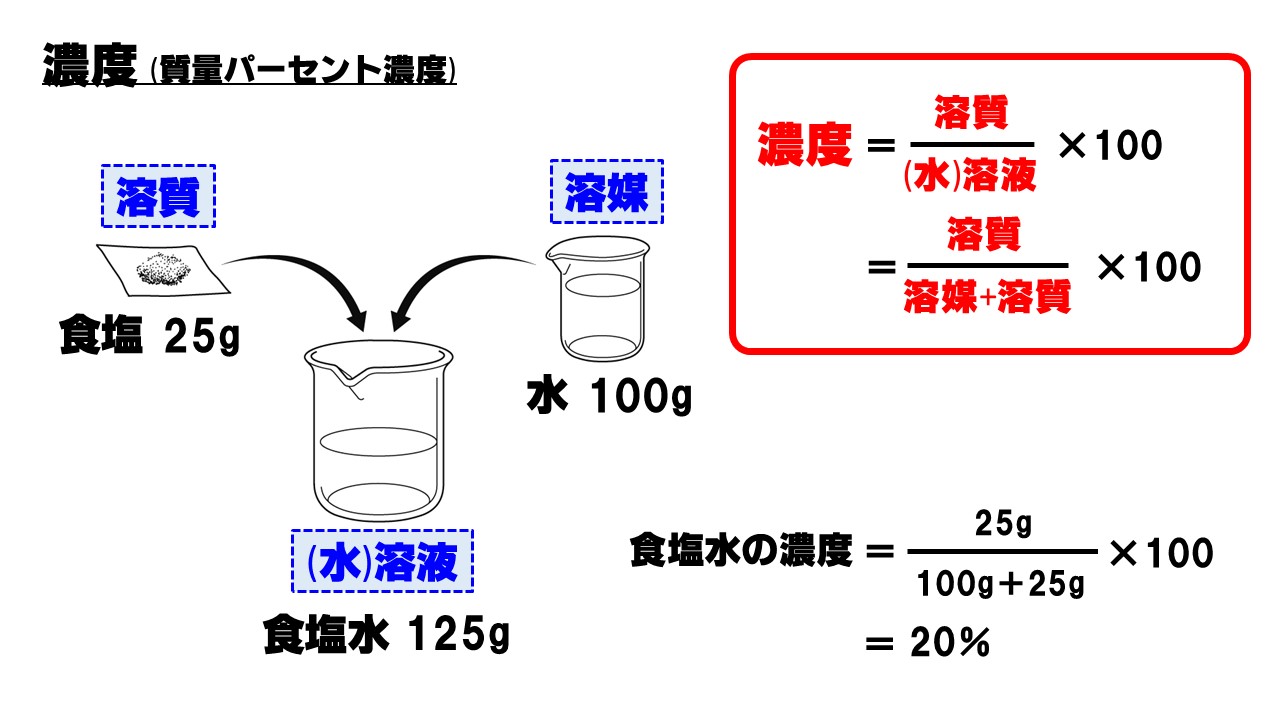
Le Plus Populaire 質量 パーセント 濃度 計算

4 6 溶液の濃度 おのれー Note
3

中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu

Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ

質量パーセント濃度の計算問題集 応用編 Menon Network

72 モル濃度の計算 0 50mol Lのグルコース水溶液と Clearnote

受験化学 9 溶解度の計算1 みかみの参考書ブログ

質量パーセント濃度の計算問題集 応用編 Menon Network
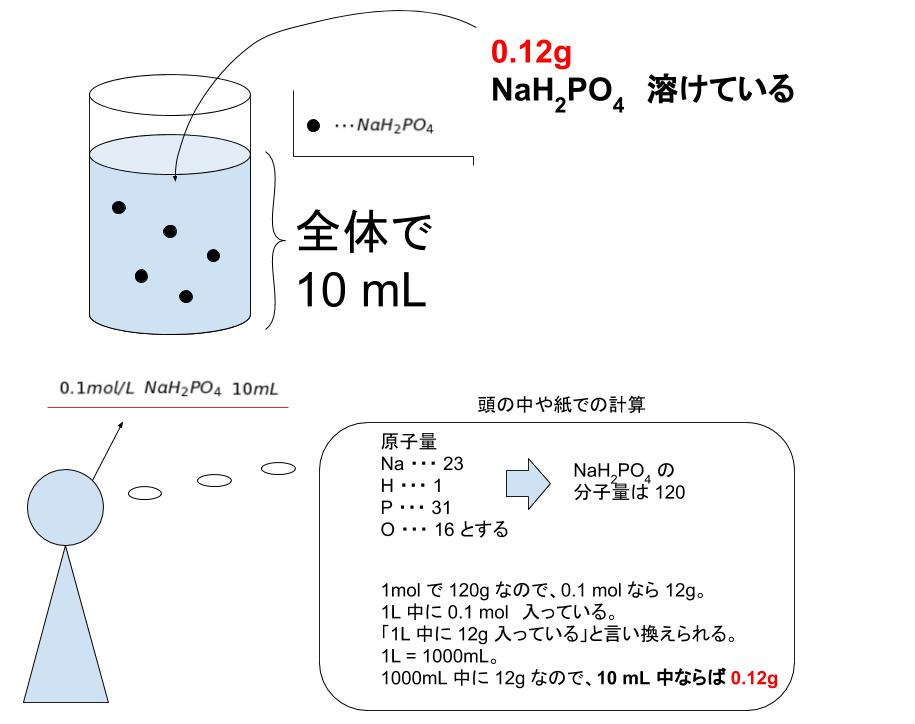
溶液の濃度計算 薬学 これでok

中1 理科 水溶液の濃度計算 ほぼ数学 Youtube
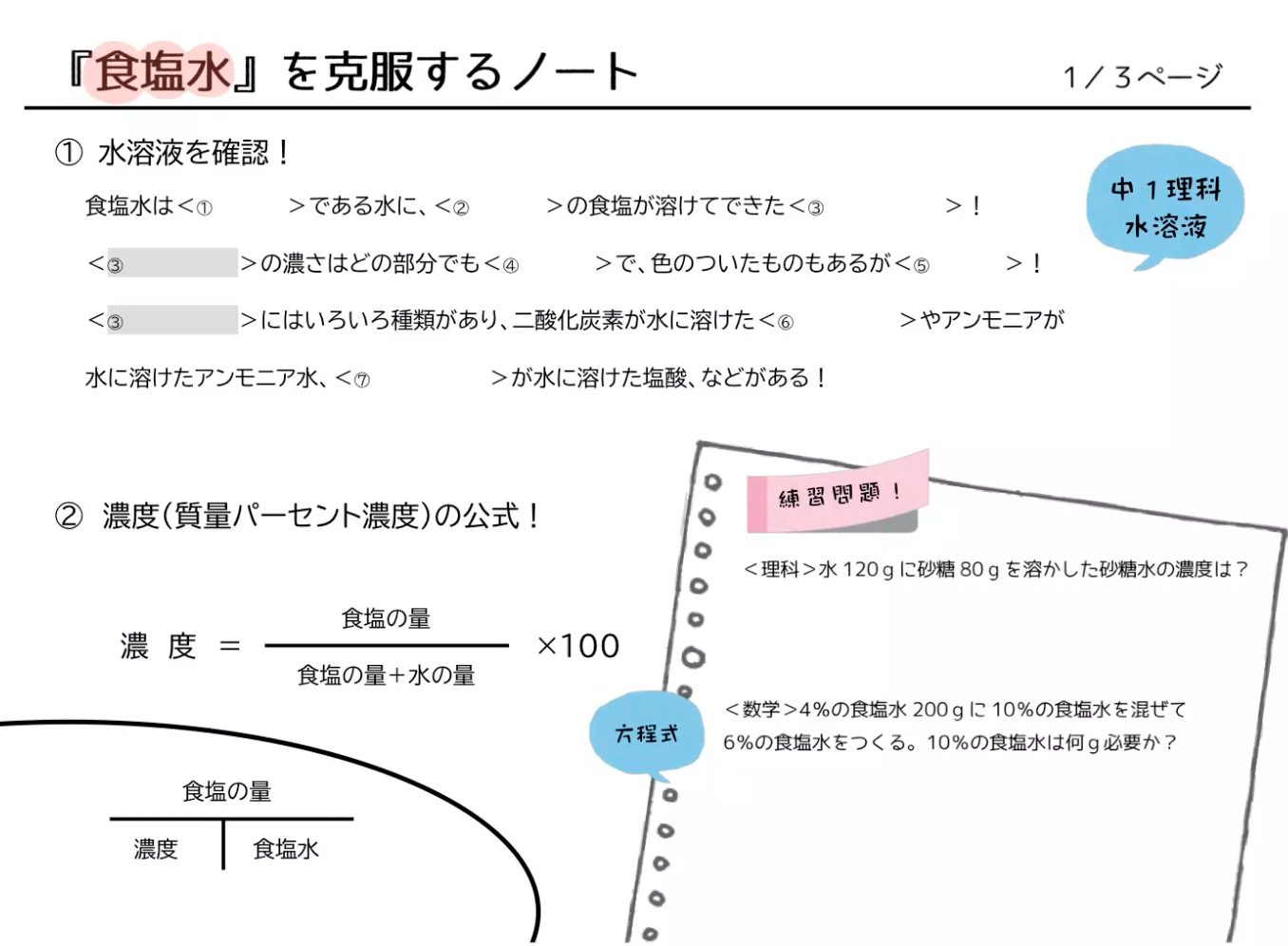
中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン

高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月

食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun

理科 中1 27 質量パーセント濃度 Youtube

3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく

中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす
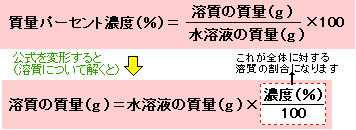
溶質を求める

3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
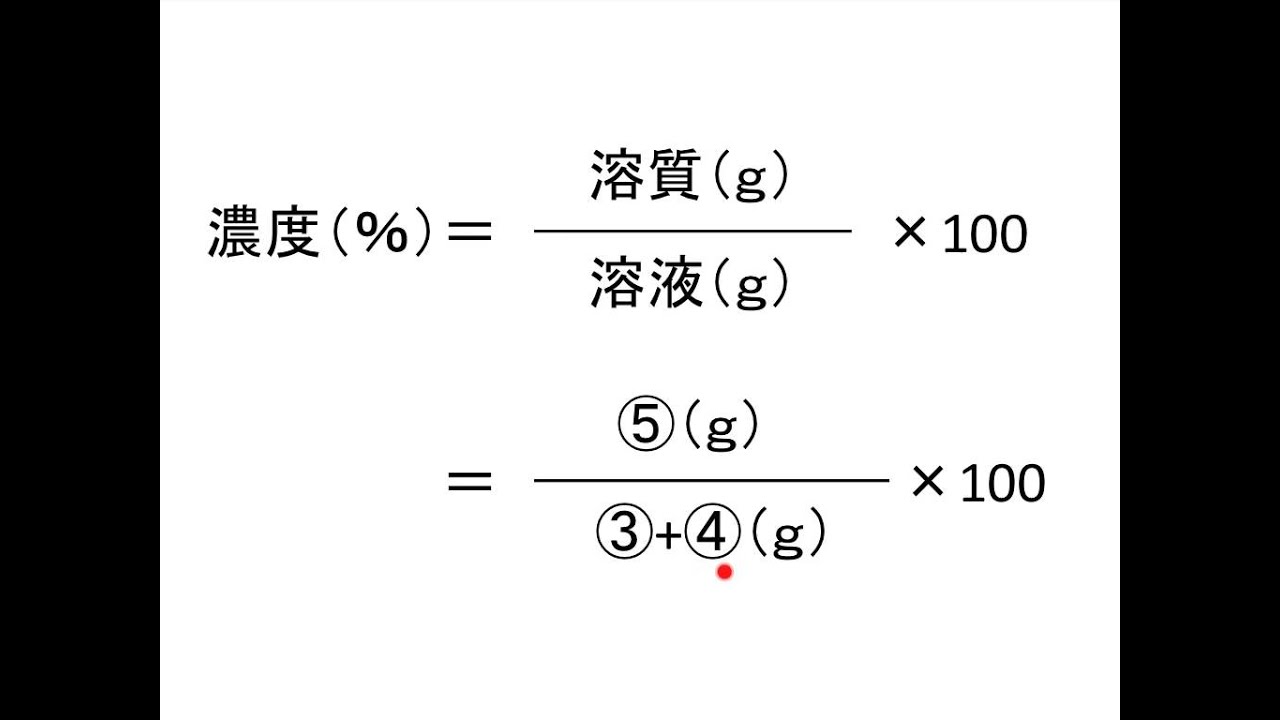
濃度の求め方 絵で覚えよう Youtube
3

モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ

基礎化学3 溶液

3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく

溶液の濃度 無料で使える中学学習プリント

モル計算 濃度計算などの問題 解説 レベルa2 ともよし塾 受験と科学の解説授業

4 6 溶液の濃度 おのれー Note

モノマナビ研究所
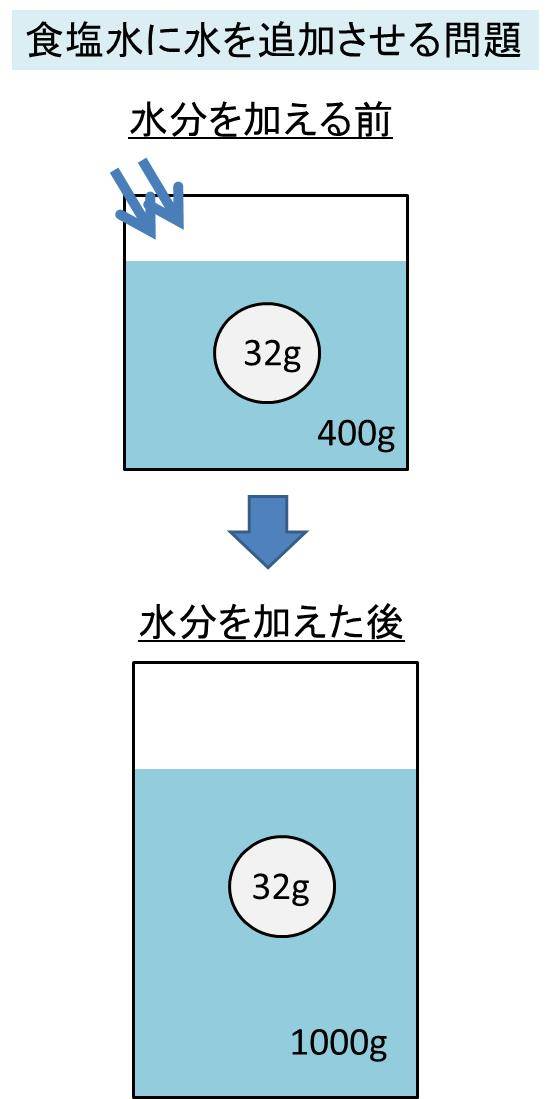
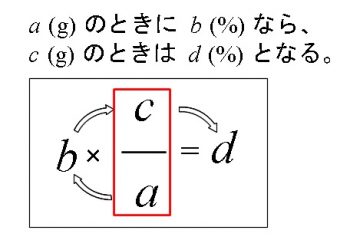
Spi 食塩水に水を追加したときの濃度の計算方法 濃度算

高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月
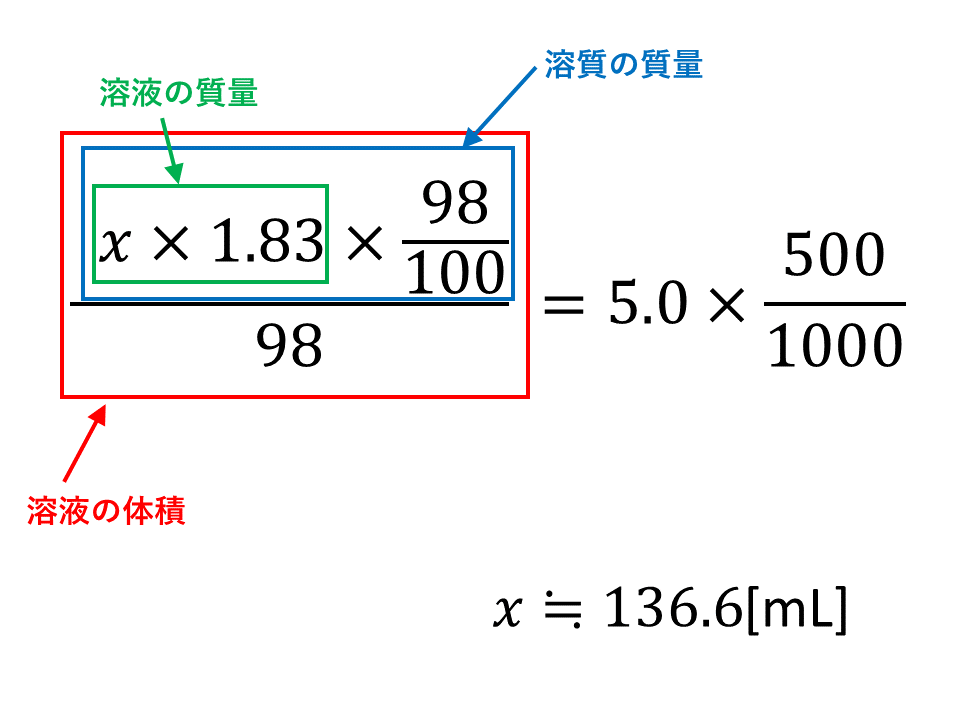
モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine

高校化学基礎 密度とモル濃度 映像授業のtry It トライイット
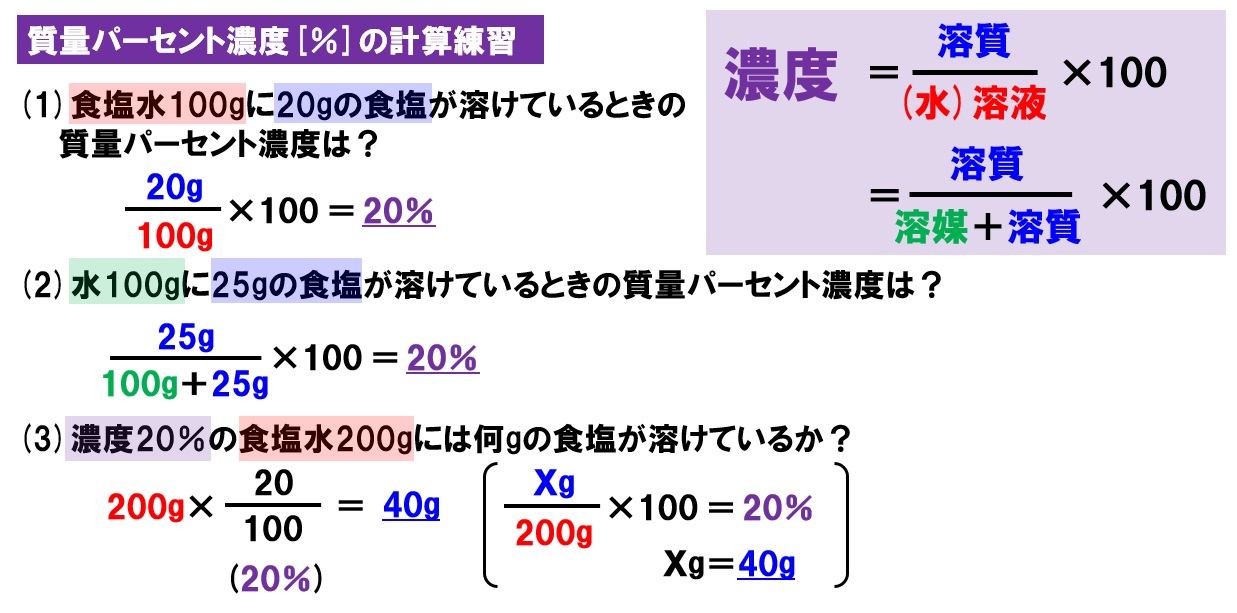
中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu
質量パーセント濃度 簡単な公式で覚えよう おときち副塾長 電脳空間学習塾かもん Youtube

モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ

中1 理科 化学 濃度の計算方法 14分 Youtube
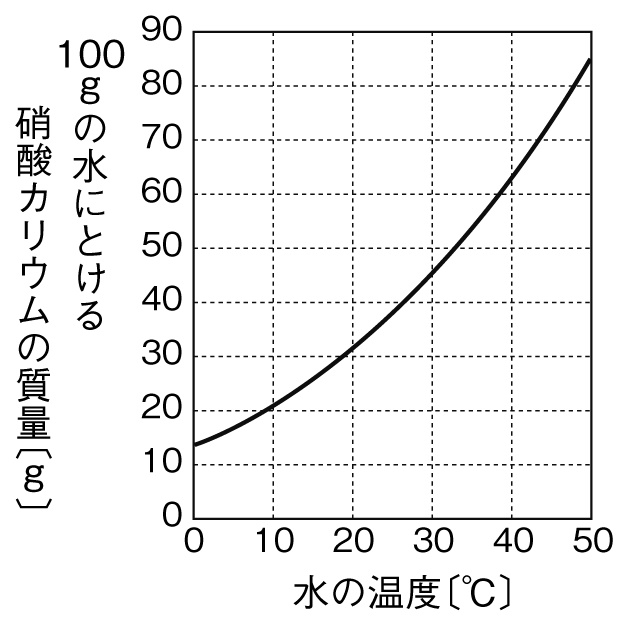
定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee
Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ

高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット
Www Jupiterimages Com

3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく
モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ

モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ
3
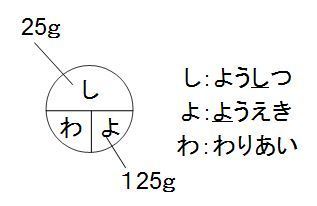
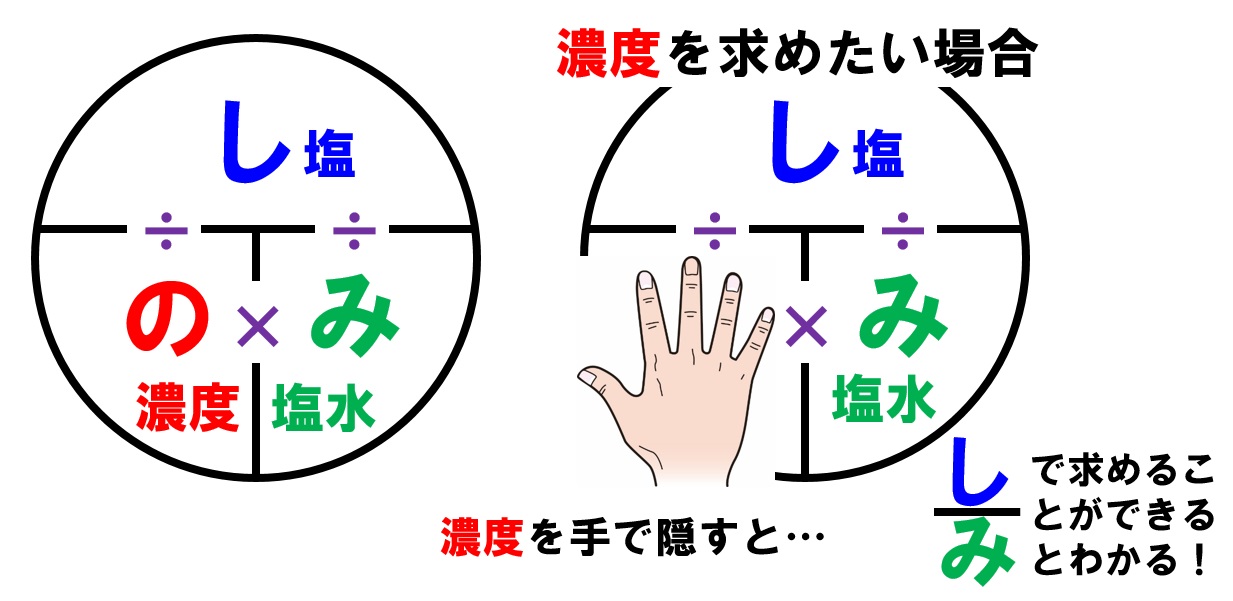
しわよ で覚える質量パーセント濃度 中学テスト 入試対策ノート

食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun

中和反応と塩 中和滴定による濃度の決定について計算式の意味がわかりません 化学基礎 定期テスト対策サイト

質量パーセント濃度の求め方とモル濃度の違い




